Leqembi: Alzheimer-Medikament ab heute erstmals erhältlich

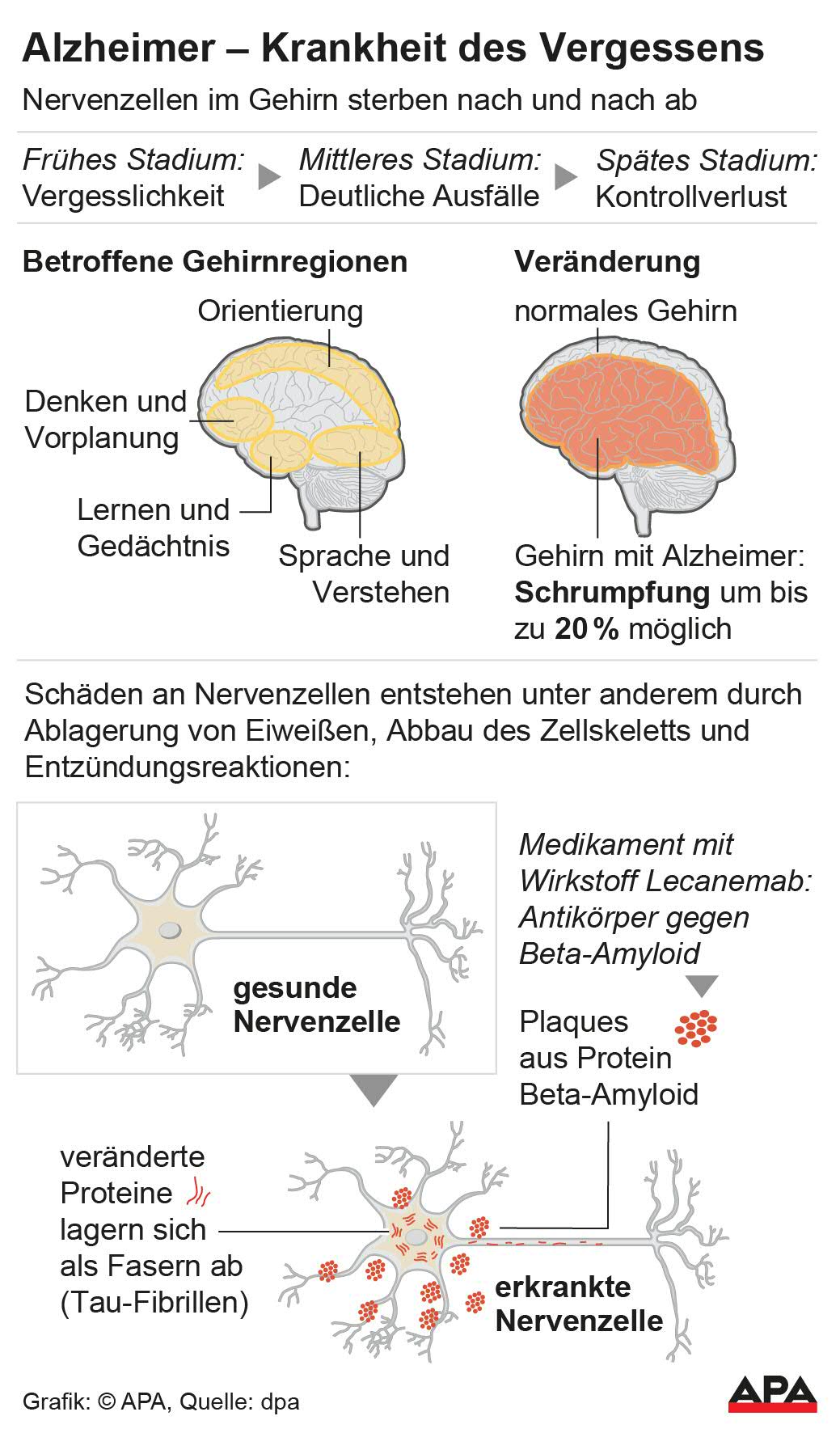
Am 1. September 2025 ist in Deutschland erstmals das Alzheimer-Medikament Leqembi verfügbar. Es enthält den monoklonalen Antikörper Lecanemab, der gezielt gegen Eiweißablagerungen (Amyloid-β-Plaques) im Gehirn vorgeht – eine zentrale Ursache der Alzheimer-Erkrankung. Die Behandlung erfolgt in Form zweiwöchentlicher Infusionen.
Laut der Deutschen Alzheimer Gesellschaft (DAlzG) ist Leqembi ein "hoffnungsvoller Schritt" – allerdings nur für Patient:innen im Frühstadium der Krankheit geeignet.
EU-Zulassung mit Einschränkungen
Nach einer kontrovers geführten Debatte hatte die Europäische Kommission im April 2025 eine eingeschränkte Zulassung für Leqembi erteilt. Zuvor hatte die EU-Arzneimittelbehörde EMA noch Bedenken geäußert, insbesondere wegen möglicher Nebenwirkungen.
In Studien zeigten 13 Prozent der Proband:innen Hirnschwellungen, bei 17 Prozent traten kleine Hirnblutungen auf – zumeist symptomlos und nur im MRT sichtbar, aber dennoch relevant für die Zulassungsentscheidung.
Wer darf Leqembi bekommen?
Die Zielgruppe ist eng definiert:
- Patient:innen mit leichten kognitiven Beeinträchtigungen, die auf Alzheimer zurückzuführen sind
- Keine ausgeprägten Gefäßerkrankungen oder Durchblutungsstörungen
- Ausschluss bei doppelter Ausprägung des ApoE4-Risikogens (erhöhtes Nebenwirkungsrisiko)
Die notwendige Diagnostik ist aufwendig: MRTs, Blutuntersuchungen und genetische Analysen sind Voraussetzung, um geeignete Kandidat:innen sicher zu identifizieren.
Fachgesellschaft fordert klare Vergütung
"Um wirklich alle Betroffenen versorgen und das Medikament in der Breite einsetzen zu können, werden auch neurologische Praxen miteinbezogen werden müssen", erklärt Prof. Dr. Peter Berlit, Generalsekretär der Deutschen Gesellschaft für Neurologie (DGN).
"Hier ist eine adäquate Vergütung der Diagnostik, der Durchführung der Therapie und der erforderlichen Überwachung im Verlauf dringend erforderlich."
Lecanemab wurde zuvor bereits in den USA und Japan zugelassen. Die heutige Markteinführung in Deutschland gilt als ein wichtiger Schritt in der Alzheimer-Behandlung – jedoch mit vielen Einschränkungen und hohen Anforderungen an Diagnostik und Therapieüberwachung.
(VOL.AT)





